9.2.1. Fénymikroszkóp
9.2.1.1. A fénymikroszkóp felépítése és működése
A mikroszkóppal dolgozók többsége a hagyományos transzmissziós vagy más néven fénymikroszkópot használja, amelynél a nagyított kép kialakításában a vizsgált tárgyon átjutó fénysugarak vesznek részt. Ennek megfelelően a világító test a tárgyasztal alatt található, vagy mozgatható tükörrel vetíthetjük alulról a fényt a tárgyra.
A fénymikroszkóp alapműködéséből következően olyan átlátszó, áttetsző tárgyak vizsgálatára alkalmas, amelyek igen vékonyak. A vékonyság nemcsak a fényáteresztés miatt fontos, hanem azért is, mert a mikrofotózásnál a mélységélesség rendkívül kicsi. A sztereomikroszkóppal ellentétben a fénymikroszkópok működésük során egyetlen tárgylencsét használnak, ezért az alkalmazásukkal készült fotók többsége utólagos manipulációkkal válhat térhatásúvá.
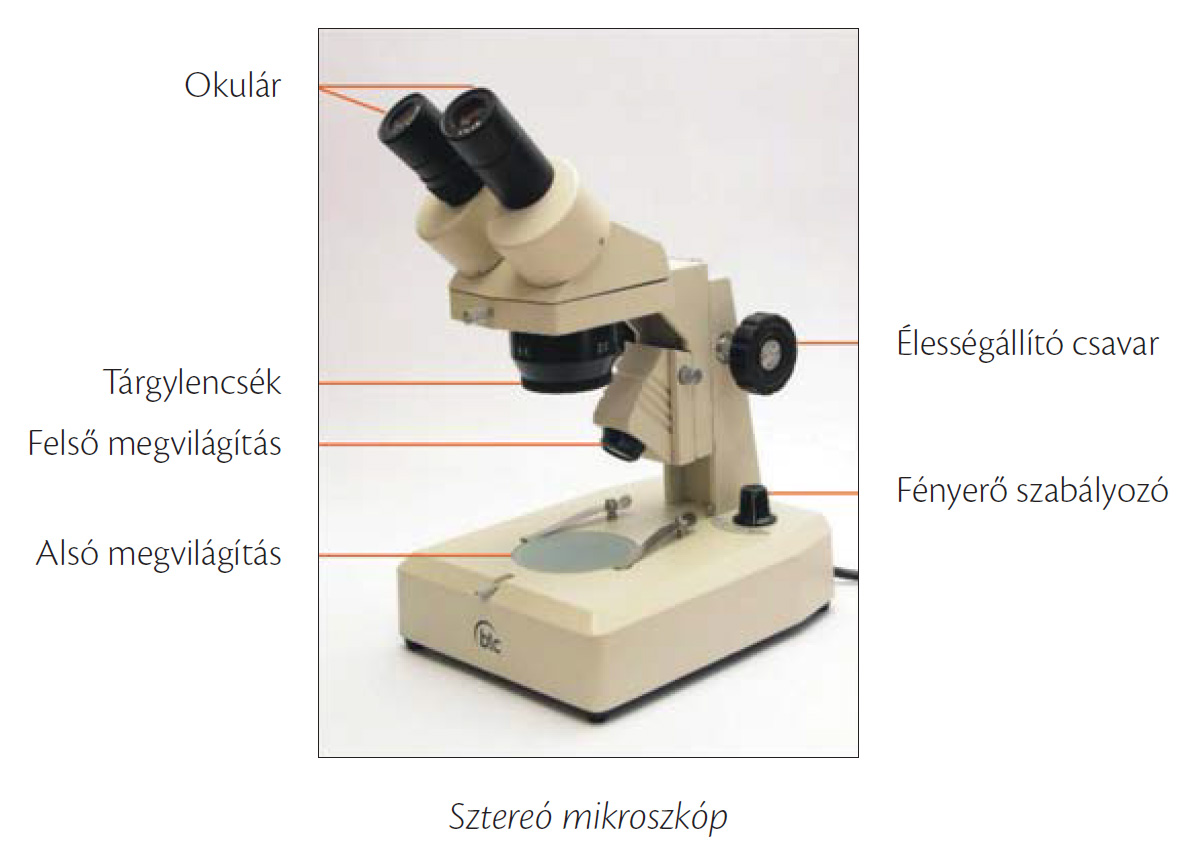
9.1. ábra. A fénymikroszkóp főbb részei

9.2. ábra. Fénymikroszkóp felülnézetből
9.2.1.2. Fénymikroszkópos vizsgálati módszerek
9.2.1.2.1. Ferde megvilágítás alkalmazása
Áttetsző objektumok (pl. keményítőszemcsék) fénymikroszkópos vizsgálatakor lehet hasznos a ferde megvilágítás alkalmazása. Ehhez, miután a tárgyat beállítottuk a fénymikroszkópban, ki kell nyitnunk teljesen a kondenzor rekeszét, majd egy sötét lappal vagy akár az ujjunkkal a kondenzor alá nyúlva tegyük féloldalivá a megvilágítást. A manipuláció eredményeként a vizsgálati objektumról térszerű kép jelenik meg a látótérben.
9.3. ábra. Bab-keményítőszemcsék ferde megvilágításban
9.2.1.2.2. Reakciók a fedőlemez alatt
Gyakran előfordul, hogy fénymikroszkóppal szeretnénk tanulmányozni a lefedett preparátumban egy reakciót. Különösen a gyors folyamatok (pl. plazmolízis, kalcium-karbonát kristályzárványok feloldása, keményítőszemcsék lugololdatos megfestése stb.) esetében fontos, hogy a reagens anyagot fokozatosan juttassuk be a fedőlemez alá. Ilyenkor ezeket átszívatással kell bejuttatnunk a fedőlemez alá. A vizsgálat során cseppentsünk a fedőlemez egyik széléhez reagenst, majd a fedőlemez szemközti széle felől egy szűrőpapírcsíkkal szívassuk át az oldatot a készítményen! A reagens ekkor fokozatosan jut be a fedőlemez alá, így a változás lassabban, fokozatosan alakul ki. Ez különösen a többfokozatú reakciók vizsgálatánál, mint például az antociánok pH szerinti színváltozásánál, fontos, amikor a vöröskáposzta-metszetbe lassan beszivárgó lúg nemcsak egy, hanem több szín megjelenését okozza.
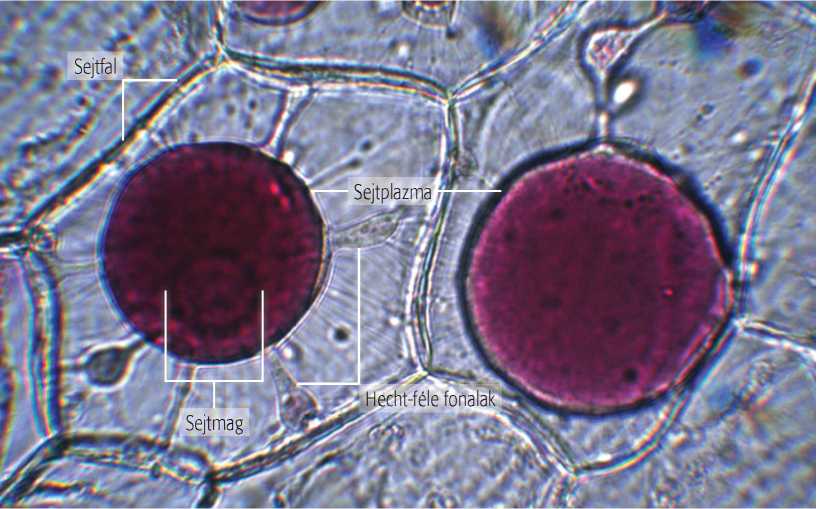
9.4. ábra. Lilahagymanyúzat plazmolízise
9.2.1.2.3. Metszetkészítés borotvapengével
A fénymikroszkópos vizsgálathoz általában igen vékony, átvilágítható metszeteket kell készítenünk, ami a legegyszerűbben egy borotvapengével tehető meg. A metszetkészítés során először egy sima vágásfelszínt kell ejtenünk a vizsgálati objektumon, majd a felület alatti újabb és újabb metszésekkel kell vékony rétegeket lehasítanunk. Borotvapengével a legegyszerűbben a jó megtartású, de nem túl kemény tárgyakból lehet vékony metszeteket készíteni. Ilyen a lágyszárak többsége, a húsos termések, raktározó szervek egy része (alma, burgonyagumó, sárgarépa stb.), vagy a mediterrán vidékről származó növények vastag bőrnemű levelei (pl. leander, fikusz), amelyek különböző irányú metszetek készítésére alkalmasak. A pozsgás növények duzzadt, kemény levele első ránézésre a metszetkészítés jó alanyának tűnik, de elvágva ezeket, a nyálkatartalmú sejtek szétesésével a levél löttyedtté válik, és csak nehezen metszhető tovább. Általában a vékony és hajlékony levéllemezekből sem egyszerű borotvapengével metszetet készítenünk, de bizonyos esetekben kerülő úton jó eredményeket érhetünk el. Nádlevélből például közvetett módon lehet keresztmetszeteket készíteni úgy, hogy a szárcsomó fölött a fiatal hajtásból készítünk metszeteket. Ekkor a szár mellett az ezt körülölelő levelekből is vékony metszetek keletkeznek, amelyek jól vizsgálhatók fénymikroszkóppal.
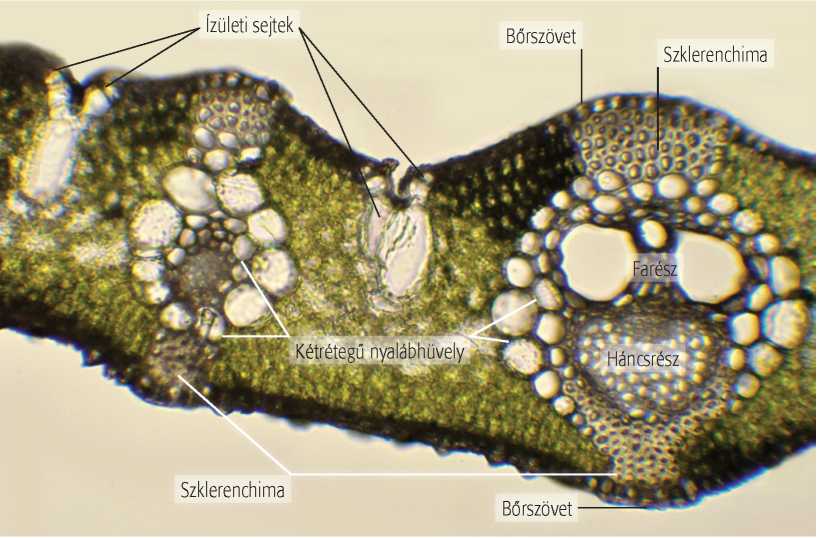
9.5. ábra. Nádlevél keresztmetszeti képe
Egy faág jó megtartású, ugyanakkor többnyire túl kemény ahhoz, hogy teljes metszetet készítsünk belőle, a felület farigcsálgatása viszont csak ritkán eredményez nagyobb méretű, egyenlő vastagságú, ugyanakkor kellően vékony, így átvilágítható metszetet. Ilyen esetekben lehet hasznos a felülvilágításos technika alkalmazása, amelyhez nem kell vékony metszetet készítenünk az ágból, akár 1–2 milliméter vastag készítményen is tanulmányozható az ág szöveti felépítése. Elsőként borotvapengével vágjuk keresztbe ketté az ágat, majd a vágásfelszíntől 1 mm-re készítsünk újabb metszetet. Az ág nehézkesebb kettémetszése után az egyes rétegek levágása könnyű feladat. Munkánk eredményeként kb. 1 mm-es vastagságú simafelszínű preparátumokat kapunk, amelyek fénymikroszkóppal is vizsgálhatók felső megvilágítás mellett. A szeletet 10–15 másodpercre helyezzük toluidinkék oldatba, majd tegyük tárgylemezre, és lefedés nélkül vizsgáljuk meg fénymikroszkóppal felső megvilágítás mellett. A felső megvilágítást olyan több power ledet tartalmazó fényforrással tudjuk megvalósítani, amely normál foglalatba csavarható be. Egy ilyen fényforrást az asztali lámpa foglalatába behajtva máris a rendelkezésedre áll egy olyan eszköz, amely képes biztosítani a vizsgálathoz szükséges kellően erős és hideg fényt. A lámpa fényét koncentráljuk a metszetre, majd kezdjük el a fénymikroszkópos vizsgálatot.
9.6. ábra. Toluidinkékkel megfestett bodzaág keresztmetszetének felső megvilágítású képe
9.2.1.2.4. A metszetek megfestése toluidinkék oldattal
A többféle szövetrendszer elemeiből felépülő metszetek (pl. szár, gyökér és levélkeresztmetszetek) gyakran elég bonyolult felépítésűek, ezért nem mindig könnyű azonosítanunk az alkotóelemeiket. Ilyenkor jelenthet nagy segítséget a preparátum megfestése toluidinkék oldattal, amely eltérő színűre festi a különböző szöveteket. A festékoldat elkészítéséhez néhány cm3 vízben keverjünk el annyi toluidinkék port, hogy sötétlila színű oldathoz jussunk. Az így kapott festékoldatot használhatjuk a továbbiakban a metszetek megfestéséhez. A metszetet helyezzük tárgylemezre egy csepp vízben, majd cseppentsünk hozzá 1–2 csepp toluidinkék oldatot. Bonctűvel finoman nyomkodjuk bele az oldatba a metszetet, hogy a festék teljesen átjárja szöveteit. 10–15 másodperc múlva szemcseppentővel szívjuk le a festékoldatot a preparátumról, majd egy másik tiszta szemcseppentő segítségével mossuk át tiszta vízzel. Fontos, hogy ne fessük túl a készítményt, mert akkor az egész feketés-lilás lesz. A toluidinkék hatására különböző színűre festődnek a különböző szövetek. Az eltérő festődést az egyes szövetek sejtjeinek más és más sejtfal sajátságai okozzák.
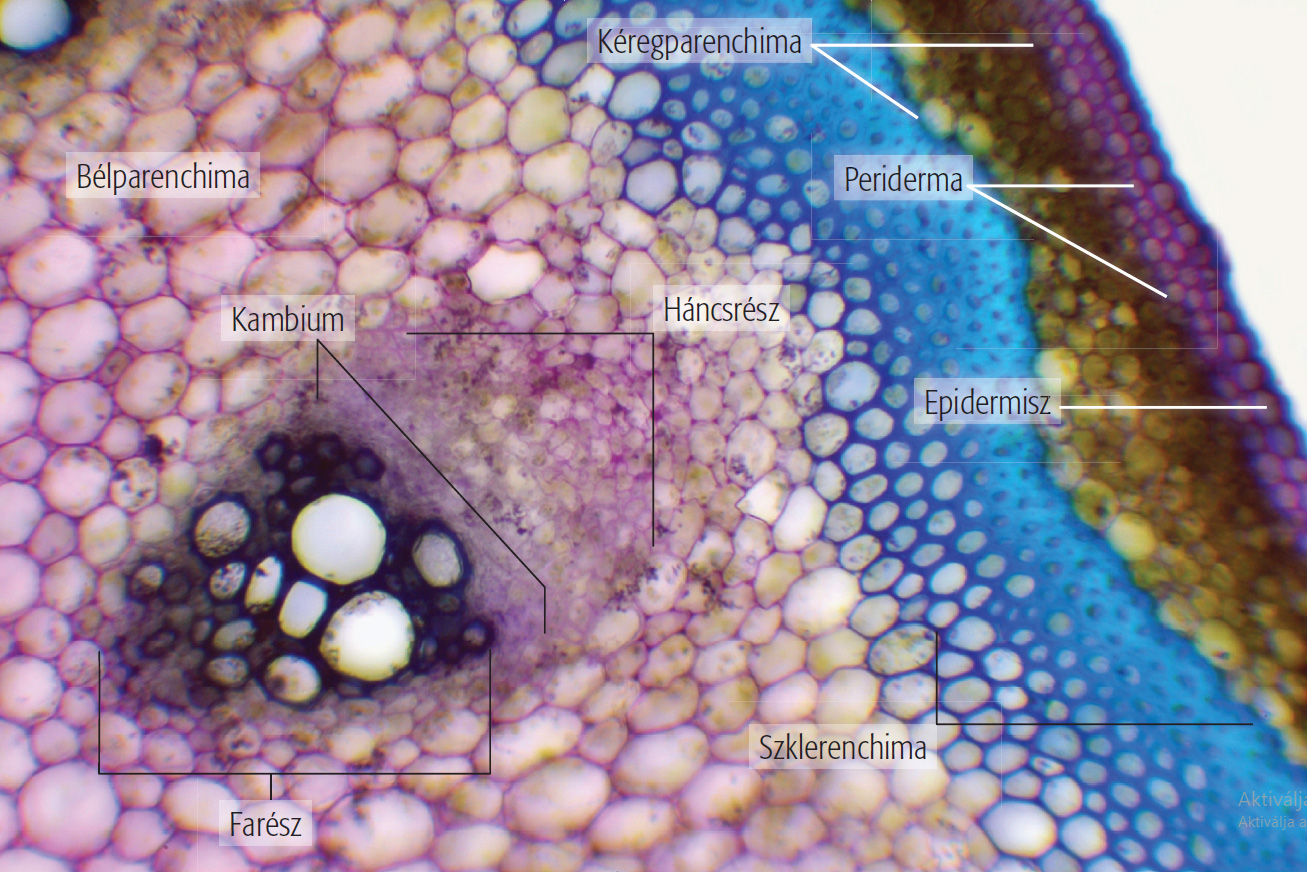
9.7. ábra. Farkasalma hajtásából készült, toluidinkékkel megfestett keresztmetszet
9.2.1.2.5. Bőrszöveti nyúzat készítése
Bőrszöveti mintát leginkább a levélből szoktunk nyerni, amelynek jellemzői meghatározzák, hogy milyen módszert érdemes alkalmaznunk a nyúzatkészítéskor. A húsos, vastagabb levelek esetében (pl. pozsgások, anyósnyelv, hagymaallevél) egy négyszöget célszerű bekarcolnunk bonctűvel a levélfelszínbe, majd a négyszög sarkánál megemelve a bőrszövetet csipesszel lehúzhatjuk a bőrszövetdarabot. Vékony leveleknél a bőrszövetmintát kaparással vagy tépéssel állíthatjuk elő. Kaparásnál szikével vagy borotvapengével kell lekapargatnunk a levél egyik bőrszövetét és a levélközepet (mezofillum), aminek eredményeként visszamarad a vizsgálni kívánt bőrszövet. Ez a módszer jól alkalmazható például a nád esetében. A tépéses módszernél egy határozott mozdulattal kell ferdén eltépnünk a levelet, aminek eredményeként a levéldarabok szélén gyakran egy néhány milliméter széles bőrszövetszegély marad meg, amelyet ollóval levágva vizsgálhatunk meg mikroszkóppal.
9.8. ábra. Anyósnyelv bőrszövetének fénymikroszkópos képe
9.2.1.2.6. Levonatkészítés
A bőrszövet és más felületek fénymikroszkópos vizsgálatára kiválóan alkalmas a levonatkészítés. Ennek során színtelen körömlakkot kell kennünk vékony rétegben például egy levélfelszínre, majd 1–2 perc elteltével, amikor a lakk már megszáradt, tűvel óvatosan felemelve és csipesszel megfogva lehúzhatjuk a bevonatot. Az így nyert színtelen készítményt tárgylemezre helyezve célszerű vizsgálnunk fénymikroszkóppal ferde megvilágítás mellett. Levonatot csak sima felszínű tárgyakról lehet készíteni, mert például egy szőrösebb levélhez úgy hozzátapad a lakk, hogy azt a száradás után lehetetlen eltávolítani.

9.9. ábra. Erdei pajzsika bőrszövetének levonata ferde megvilágításban
9.2.1.2.7. Optikai festés
A fénymikroszkóppal vizsgált készítmények többnyire kevésbé színesek, ezért kisebb esztétikai élményt nyújtanak. Az összetett festési eljárások pedig bonyolultságuk miatt riasztják el az érdeklődőket. Az alábbiakban egy olyan módszert – az optikai festést – ismertetek, amely igen egyszerű módon teszi varázslatos színűvé mikroszkópi készítményeinket. Színes, átlátszó irattartó mappából vágjunk ki 1–2 cm-es korongot, és ennek közepét lyukasztógéppel vágjuk ki! Az aprócska lyuk helyére ragasszunk egy másik színű mappából kivágott korongocskát! Az így kapott, a felfedezőjéről elnevezett Rheinberg-szűrőt helyezzük úgy a tárgyasztal alatt a fény útjába (a szűrőtartóba), hogy a kisebb, középső színes korong pontosan középen legyen. A szűrő helyének és (ha van) a rekesznyílás méretének változtatgatásával beállíthatunk egy olyan helyzetet, ahol a mikroszkópban vizsgált tárgy a nagyobb színes korong, míg a háttér a kisebb színében pompázik. A már beállított szűrőt érdemes ragasztószalaggal rögzítenünk. A középső kisebb korongból ajánlatos többet is egymásra ragasztani, hogy szebb színű legyen a háttér. A legszebb színhatásokat a sárga-kék, piros-zöld, piros-kék szűrőkkel lehet elérni.
Lovas-féle színes, sötét látóteres technika abban különbözik a Rheinberg-féle módszertől, hogy a kisebb színes korongot színtelen fóliára vagy üveglapra ragasztjuk, így csak a háttér lesz színes, míg a tárgy az eredeti színét mutatja.
9.2.1.2.8. Fotózás, filmezés
A fénymikroszkópos fotózás egyik lehetőségét jelenti az, amikor az okuláron keresztül fényképezzük le a vizsgált anyagot. Tökéletesebb megoldást jelent a projekciós lencsét tartalmazó fotófeltét alkalmazása. Ezt a trinokuláris mikroszkópok esetében a harmadik tubushoz, míg bi- vagy monokuláris mikroszkópoknál a leszerelhető felső tubus helyére illeszthetjük. A beépített projekciós lencsével jó minőségű képet kapunk, amely teljesen kitölti a képmezőt. A fotófeltét gyakran beállító okulárt is tartalmaz, ami lehetővé teszi, hogy az élességállítás itt történjen, ne a fényképezőgép keresőjén keresztül. A beállító okulár keresője jobban ki van világítva, mint a fényképezőgépé, és ez pontosabb élességállítást tesz lehetővé. A fényképezés előtt ne felejtsük el összehangolni a két keresőt a beállító okuláron található drioptriagyűrű segítségével, hogy mindkettőben egyszerre alakuljon ki az éles kép. Ha nem tökéletes mind a két kép, akkor először a fényképezőgépben kialakuló képet állítsuk élesre a mikroszkóp élességállító csavarjával, majd a beállító okulár dioptriagyűrűjével az itt kialakuló képet is korrigáljuk.

9.10. ábra. Fotóadapter fénymikroszkóphoz
A digitális technika fejlődése eredményeként ma már a mono-, a bi- és a trinokuláris mikroszkópok tartozékaként beszerezhetők digitális fotó- és videokamerák, amelyek alacsony árfekvésük miatt mindenki számára lehetővé teszik a mikroszkópos témák megörökítését. Ezek a hozzájuk tartozó szoftver telepítése után számítógéppel összekötve működtethetők. A mikroszkópos kép és a kamera kezelőfelülete is a számítógép monitorján jelenik meg. A számítógépes program telepítése nem mindig egyszerű és az elkészült kép, film minősége, felbontása sem túl jó, ami a gátat szab ezek szélesebb körű publikálásának. Ezért sokkal célszerűbb egy alacsonyabb árfekvésű tükörreflexes digitális kamerát kapcsolni a számítógéphez. Ez nagy felbontású fényképek és filmfelvételek elkészítését teszi lehetővé. A kamerák kisméretű LCD kijelzői viszont nehézkessé teszik a mikroszkópos kép élesre állítását, ezért olyan fényképezőgépet válasszunk, amely rendelkezik mini-HDMI kimenettel, ami lehetővé teszi, hogy a kamerát összekapcsoljuk egy HDMI bemenettel rendelkező monitorral. A monitor nagyméretű képernyője egyrészt a kép tökéletes élesre állítására, másrészt csoportos szemléltetésre is lehetőséget ad.
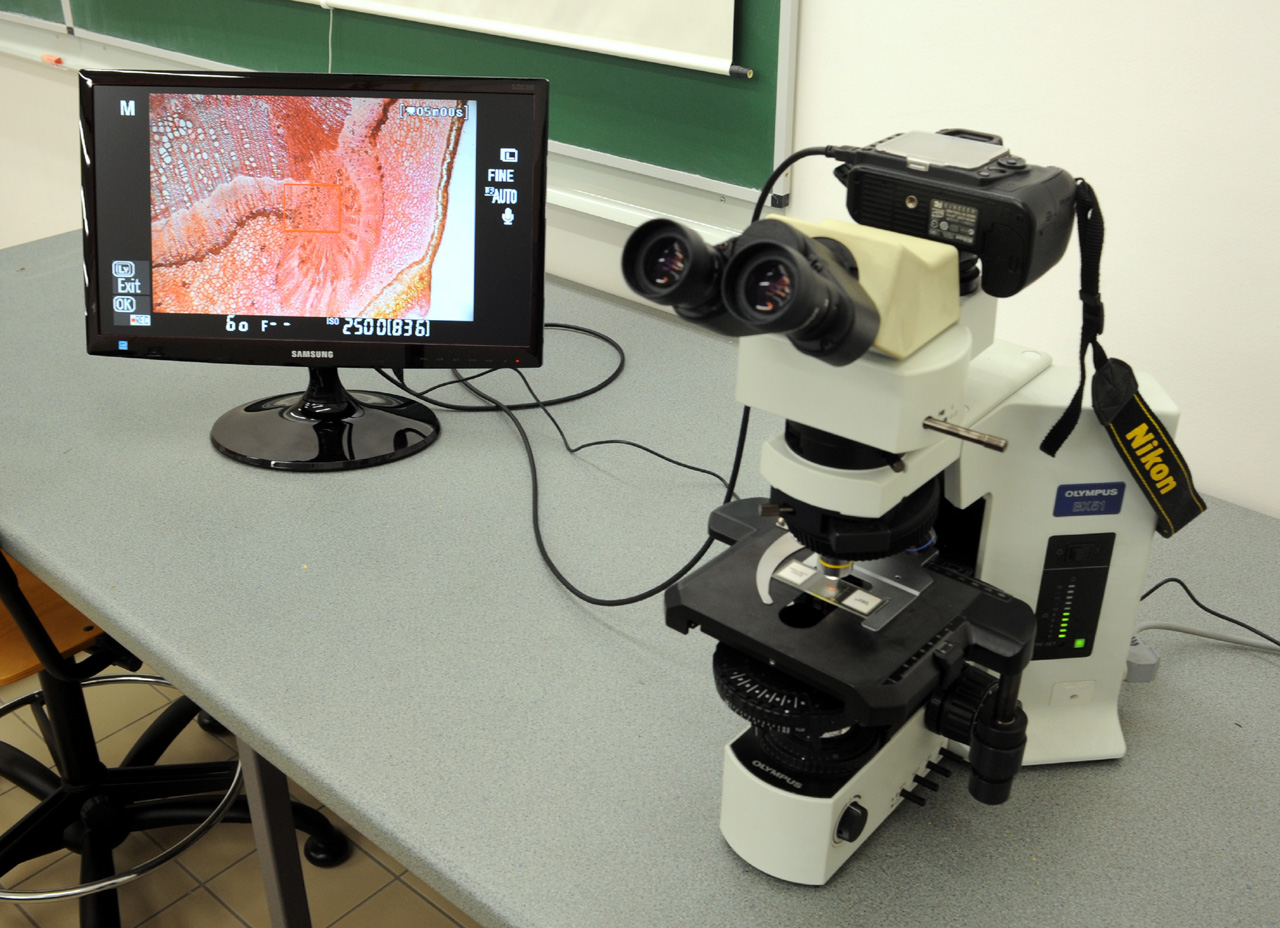
9.11. ábra. Összekapcsolt fénymikroszkóp, fényképezőgép és monitor
A mikroszkópos téma bemutatása során bármikor lehetőségünk van ennek álló- vagy mozgóképes rögzítésére. Az így elkészült eredeti digitális anyagokat a későbbiekben jól használhatjuk a frontális tevékenységek és az elméleti csoportfoglalkozások során is. Exponáláskor ajánlatos kioldózsinórt használni, hogy a zár csapódásakor elkerüljük a tárgy elmozdulását. Kevésbé korszerű digitális kamerák alkalmazása esetén erős fényű megvilágításnál is előfordulhat, hogy az expozíciós idő több másodperces. Ilyen esetben vakut kell használnunk. Ennek erős fénye lehetővé teszi a rövid expozíciós idővel történő fényképezést. Ha a mikroszkópunk beépített fényforrással rendelkezik, akkor a vaku elhelyezését úgy tudjuk megoldani, hogy az alsó fényforrás fölé egy 45 fokos szögben megdöntött, néhány cm2-es üveglapot vagy féligáteresztő tükröt állítunk, és vele szemben helyezzük el a vakut, amit zsinórral csatlakoztatunk a fényképezőgéphez. Így megoldható, hogy a mikroszkóp saját fényforrását használva állítsuk be a fényképezendő tárgyat, ugyanakkor az exponálás során az üveglapról a tárgyra vetődő erős vakufény biztosítja a rövid exponálás lehetőségét. Ha a mikroszkóp nem rendelkezik saját fényforrással, akkor az állítható tükör helyébe kell tennünk a 45 fokos szögben beállított féligáteresztő lapot, és a vaku ez alatt helyezkedik el. Ebben az esetben a mikroszkóp lámpát állítjuk az üveglappal szembe. Ahhoz, hogy a fényképeink egyenletes megvilágításúak legyenek, fontos, hogy a tükör pontosan 45 fokos szögben legyen beállítva. A korszerű digitális kamerák esetében lehetőségünk van olyan magas filmérzékenységet (ISO) is beállítani, amely módot ad rövid (1/60 sec) expozíciós idő alkalmazására még erős nagyítású, fényszegény mikroszkópos beállítás esetén is. Ezért vakuhasználat nélkül is készíthetünk tökéletes felvételeket akár gyorsan mozgó egysejtűekről is.
Fénymikroszkóppal is készíthetők különböző módszerekkel sztereoképek, de ezek térszerűsége jelentősen elmarad a sztereomikroszkóppal készült fotók mögött, a tárgylencsék igen kicsi mélységélessége miatt. Az egyik módszer alkalmazásakor azt használjuk ki, hogy a tárgylencse két fele egy kissé más szögben látja a mintát. A 3D kép előállítása érdekében azt kell elérnünk, hogy a jobb oldali tárgylencsefélből csak a bal, míg a bal oldali objektívfélből csak a jobb szemünkbe jusson a fény. Ezt úgy érhetjük el, ha a kondenzor szűrőtartójába vagy a tárgylencse hátsó fókuszsíkjába 1-1 polárszűrőt teszünk, amelyek egymásra merőlegesen polarizáltak, és az okulárokat is ellátjuk a megfelelő irányban álló polárszűrőkkel. A polárszűrők helyett alkalmazhatunk vörös és kékeszöld szűrőket is. Ilyenkor a kondenzor szűrőtartójába vagy az objektív hátsó fókuszsíkjába olyan szűrőt teszünk, melynek egyik fele vörös, másik fele kékeszöld színű. A megfelelő okulárokra pedig egy kékeszöld, illetve egy vörös szűrőt teszünk. Az ilyen módszerrel kapott két különböző képet egyenként fotózzuk le. Ez a módszer nemcsak sztereoképpárok készítésére alkalmas, hanem a minta 3D-s vizsgálatát is lehetővé teszi. 3D-s fénymikroszkópos képek előállítására választhatjuk azt a megoldást is, hogy a kondenzor szűrőtartójába egy átvilágíthatatlan félkör alakú lemezt teszünk bal, majd jobb oldalra, és így készítjük el a felvételeket.
9.2.2. Sztereomikroszkóp
9.2.2.1. A sztereomikroszkóp felépítése és működése
A sztereomikroszkóp mindig binokuláris, azaz két szemlencséje van. A különlegessége mégsem ez, hanem az, hogy a tárgylencséből is kettő van.
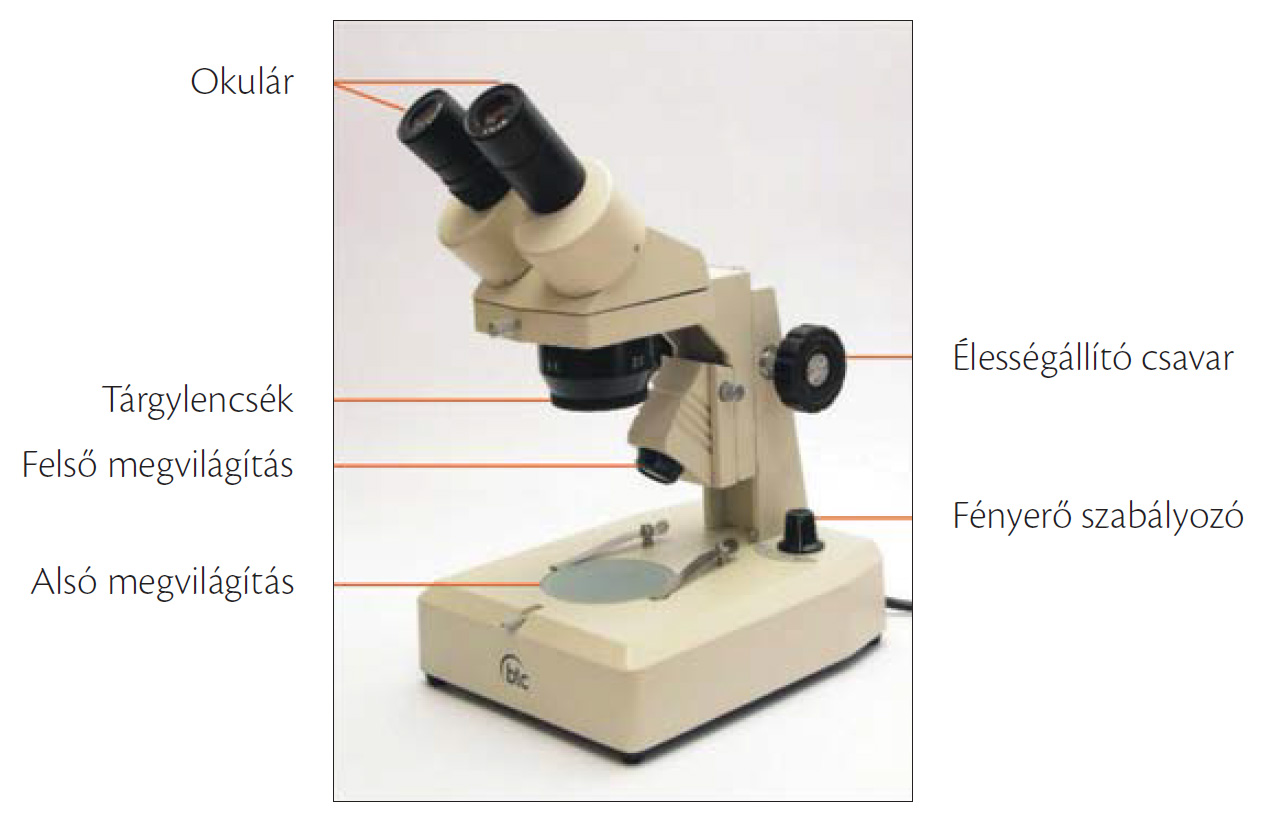
9.12. ábra. Sztereomikroszkóp
Ez utóbbiak olyan szögben és távolságban vannak beállítva, hogy nem teljesen ugyanazt a képet adják a tárgyról, így a két kissé eltérő kép eredőjeként egyetlen, de térhatású képet látunk a mikroszkópban. A sztereomikroszkóp a transzmissziós fénymikroszkóppal ellentétben elsősorban a fényt át nem eresztő objektumok vizsgálatára használatos, ugyanakkor az esetek többségében az eszköz alsó megvilágítási lehetőséggel is rendelkezik. Az alsó megvilágításnál tükörrel vetítjük a fényt a tárgyra. Manapság a beépített fényforrásuk hideg fényű megvilágítást biztosít, ami különösen az élő anyagok vizsgálatánál fontos.
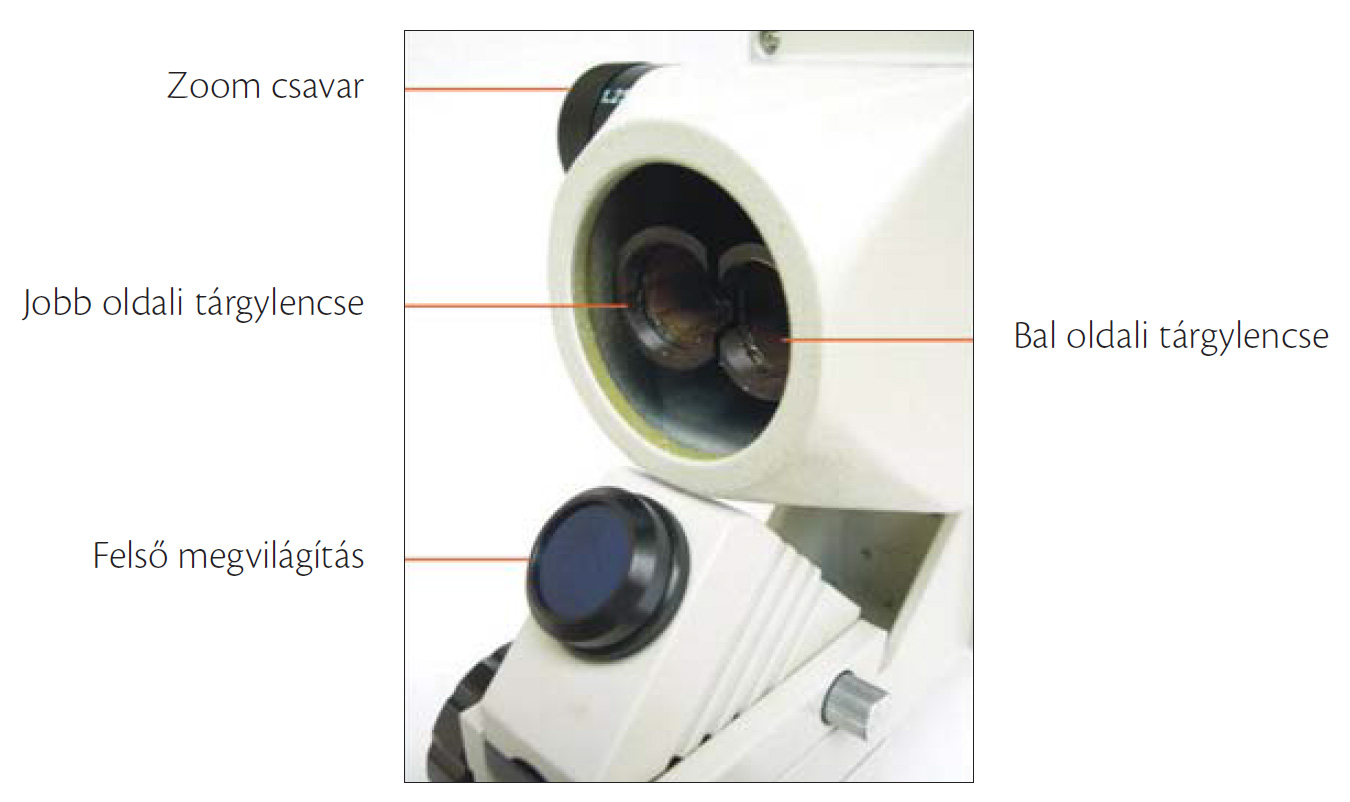
9.13. ábra. Sztereomikroszkóp és alulnézeti képe
9.2.2.2. Sztereomikroszkópos vizsgálati módszerek
Ma már az oktatásban használható olcsóbb árfekvésű sztereomikroszkópok többsége is trinokuláris, ami azt jelenti, hogy míg két okuláron keresztül a tárgyat vizsgáljuk, addig a harmadikhoz kamera kapcsolható. Az igazán komoly mikroszkópokhoz pedig gyakran 2–3 fényképezőgépet is lehet egyidejűleg csatolni. A sztereomikroszkópos képrögzítés a fénymikroszkópnál leírtakkal megegyező módon történik.
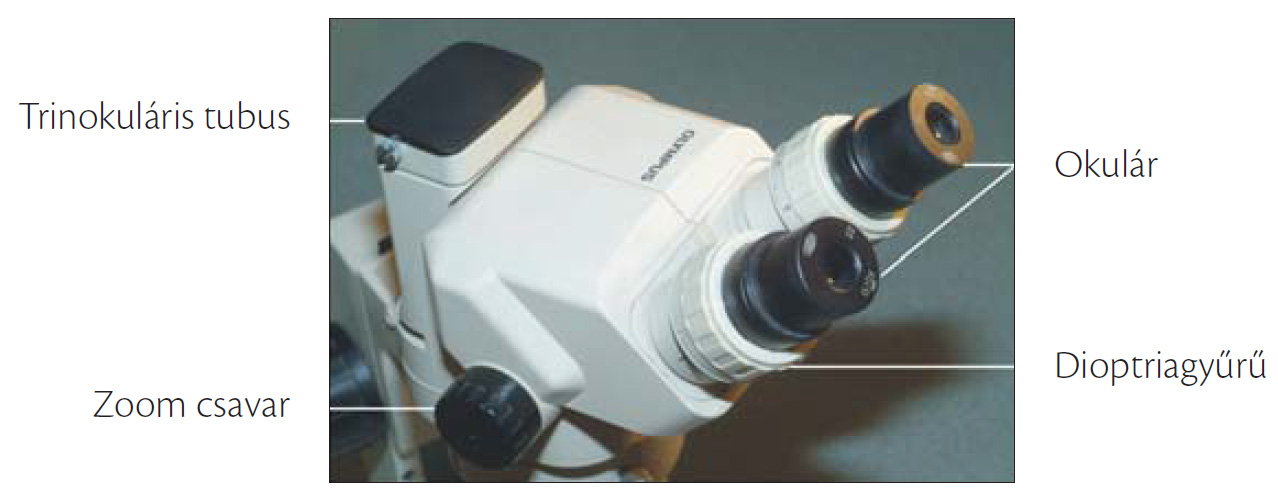
9.14. ábra. Trinokuláris zoom sztereomikroszkóp
9.2.2.2.1. 3D fotózás sztereomikroszkóppal
A térhatású felvételek elkészítéséhez mindkét tárgylencsén keresztül le kell fotóznunk a vizsgált objektumot, ezért ilyen célú felhasználás során nem jelent előnyt a trinokuláris sztereomikroszkóp alkalmazása.

9.15. ábra. A fényképezőgép csatlakoztatása az egyik okulárhoz
Térhatású fotózásnál az okulárt tartalmazó tubushoz kell rögzítenünk a fényképezőgépet. A fényképezőgép rögzítése mechanikus úton történhet a tubushoz vagy a fotófeltéthez. Élő anyag mikroszkópos vizsgálatakor gyakran csak hideg fényes megvilágítást használhatunk, amit erős fényű, fehér ledeket tartalmazó lámpák alkalmazásával tudunk megvalósítani. Ezek a hagyományos izzófoglalatba is becsavarható lámpák jól koncentrálható fehér fényű megvilágítást biztosítanak. Fényképezéskor a tárgyat érdemes legalább két irányból megvilágítani, hogy ne alakuljanak ki túlságosan árnyékos részek. A sztereomikroszkópos fotózás igen fényigényes, ezért ha rövid expozíciós időt kell választanunk mozgó tárgy esetében, akkor villanófényt kell használnunk, vagy magas filmérzékenységet kell beállítanunk. Ha 1 vagy 2 vakut használunk, akkor ezeket kb. 45 fokos szögben irányítsuk a tárgyra, mert így elkerülhető a zavaró betükröződés. Sztereomikroszkóppal mozgásban lévő objektumokról is készíthetünk térhatású felvételeket, két fényképezőgép együttes használatával. Ilyenkor a jobb és bal oldali okulárhoz is csatlakoztatunk egy-egy fényképezőgépet.
9.3.3. Háromnézetű bogárnéző
9.3.3.1. A bogárnéző felépítése és működése
A bogárnéző felső része egy fedővel lezárható, átlátszó, vízálló pohár, amely az alsó zárt hengeres részre illeszthető. A műanyag pohár eltávolítható fedele két nagyítólencsét tartalmaz.

9.16. ábra. A háromnézetű bogárnéző és részei
Az egyik bele van építve a fedő közepébe, míg a másik egy erre ráhajtható újabb nagyító. A bogárnéző kipróbálásához húzzuk le a műanyag pohár nagyítós fedelét és helyezzünk egy fél centiméter vastag citromkarikát vagy paradicsomszeletet a pohár aljára! A fedél visszahelyezése után kezdjük meg a vizsgálatot! Elsőként hajtsuk fel a fedő nagyítólencséjét, és csak a beépített lencsén keresztül vizsgáljuk meg a tárgyat.

9.17. ábra. A tárgy felülről történő megfigyelése bogárnézővel
Ahhoz, hogy éles képet lássunk, távolabbról kell a bogárnézőbe tekintenünk (bal oldali kép), ami azt eredményezi, hogy a tárgyat két szemmel tudjuk nézni. Ez azért nagyon fontos, mert így térhatású képet láthatunk. A nem túl erős nagyítás miatt a kép mélységélessége kiváló, ami azt jelenti, hogy a tárgy minden részletét élesnek látjuk. Az éles és egyben térhatású kép igazi esztétikai élményt nyújt a vizsgálat során. Ezután hajtsuk rá a másik nagyítólencsét a fedőre és vizsgáljuk meg így is a tárgyat! Az újabb lencsével erősebb nagyítást tudunk elérni, de ekkor már közelről kell a bogárnézőbe néznünk, hogy éles képet lássunk. Az egyszemes vizsgálat már nem teszi lehetővé a térhatású kép megjelenését, amiért cserébe az erősebb nagyítás kárpótolhat. A bogárnéző alsó tükrös és nagyítós része lehetőséget ad a tárgy alulról történő megfigyelésére ennek megfordítása nélkül. Ez különösen egy bogár vizsgálata során lehet előnyös, mert az állat fordítgatása nélkül tudjuk alulról és felülről tanulmányozni a testfelépítését. A bogárnéző pohárrésze teljesen átlátszó, ami nemcsak az alulról és felülről történő, hanem az oldalirányú vizsgálódást is lehetővé teszi. A tanulmányozott tárgy megvilágítása nem igényel külön fényforrást, ezért az eszköz egyaránt használható mesterséges tantermi/szobai és természetes megvilágítás mellett.

9.18. ábra. A tárgy alulról történő megfigyelése, térhatású és kis nagyítású kép
Az alulról történő megfigyelést lehetővé tevő nagyítószerkezet a pohárfedőn találhatóhoz hasonlóan két részből áll. Ez a már ismertetett módon lehetővé teszi a tárgy kis nagyítású térhatású és erős nagyítású kétdimenziós (egyszemes) vizsgálatát. A bogárnéző alsó része lehetőséget ad a tárgyak áteső fénynél való vizsgálatára is. Ehhez elegendő egy zseblámpával bevilágítanunk az alsó kémlelőnyílásba, miközben felülről, a pohárfedő nagyítólencséin keresztül tanulmányozzuk a tárgyat. Ezzel a módszerrel, a fentiekben márt leírtak szerint, kis nagyítású, térhatású és erősebb nagyítású kétdimenziós képet láthatunk a tárgyról. Ma már nagyon olcsón, egy-kétszáz forintért be lehet szerezni olyan erős fényű (power led-es vagy halogénizzós) zseblámpákat, amelyek jól használhatók fényforrásként. Az áteső fényű megvilágítás alkalmazása leginkább az áttetsző tárgyak, például húsos termések vizsgálatánál lehet hasznos. A termésből nem szükséges túl vékony metszetet készíteni, mert az erős lámpafény az 1–2 cm-es szeleteket is képes átvilágítani. Az ilyen típusú vizsgálatoknál különösen a kétszemes vizsgálat ad fantasztikus látványt, mert ekkor nagy mélységélességű és háromdimenziós képet láthatunk, ami lehetőséget ad a metszet térbeli felépítésének megismerésére.
A bogárnéző fedelében elhelyezett és a kihajtható nagyítólencsék önmagukban is használhatók, ami lehetővé teszi a nagyméretű tárgyak vizsgálatát is.
9.2.3.2. Bogárnézős vizsgálatok
9.2.3.2.1. A magas kőris rendes és alvó rügyei
Vizsgáljuk meg bogárnézőben a magas kőris ágvégét! A vizsgálandó ágrészletet úgy vágjuk le, hogy az ágvégi és a lejjebb található rügyeket is hordozza. A rügy elhelyezkedése alapján lehet csúcsrügy, amely a hajtásvégen helyezkedik el, és a hosszanti növekedést biztosítja és lehet oldalrügy, amely közvetlenül a csúcsrügy alatt oldalt állva a csúcsrügy pusztulása esetén helyettesíti az utóbbit. Gyakran a csúcsrüggyel együtt az oldalrügyek is kihajtanak, ami a hajtás elágazódásához vezet.
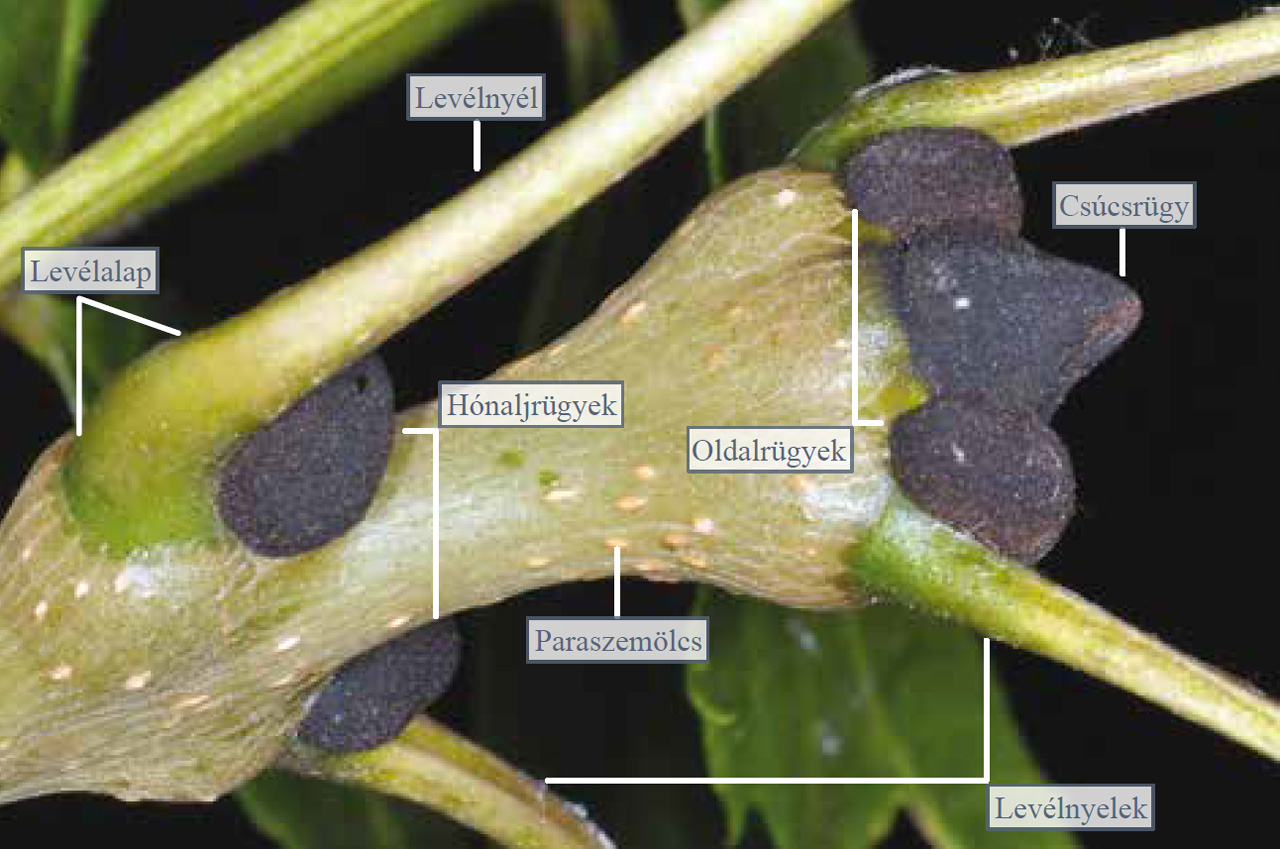
9.19. ábra. A csúcs- és oldalrügyek alatt a levélnyelek tövében hónaljrügyek láthatók
A hónaljrügyek a levelek eredésénél, ezek hónaljában találhatók. A fenti három rügytípus (rendes rügyek) mellett léteznek még az úgynevezett alvórügyek is, amelyek a rendes rügyek elpusztulása esetén indulnak fejlődésnek. Ezek a szár héjkérge alatt vagy a levelek levélalapja alatt rejtőznek.
Az ágvég testesíti meg a fa ez évi, új hajtását, amely zöldes színéről és levélhónaljban elhelyezkedő fejlett rügyekről ismerhető fel. Ez alatt látható az előző évben kifejlődött ágrészlet, amely már nem visel leveleket, de jól felismerhetők rajta az egykori levelek korábbi kapcsolódási helyei, íves bemetszések formájában. A hajdani levéleredések nyomát a száron levélripacsnak nevezzük. A levélripacs középső részén figyelhetők meg az alvórügyek, amelyek olyan oldal- és hónaljrügyek, amelyek „tartalékállományba” kerülve nem indultak fejlődésnek. Ezek csak akkor hajtanak ki, ha valami oknál fogva a rendes rügyek elpusztulnak.

9.20. ábra. Alvórügyek a magas kőris ágán. Az alvórügyek az előző évi ág ki nem hajtott hónaljrügyeiből alakultak ki
9.2.3.2.2. A fatörzs vizsgálata
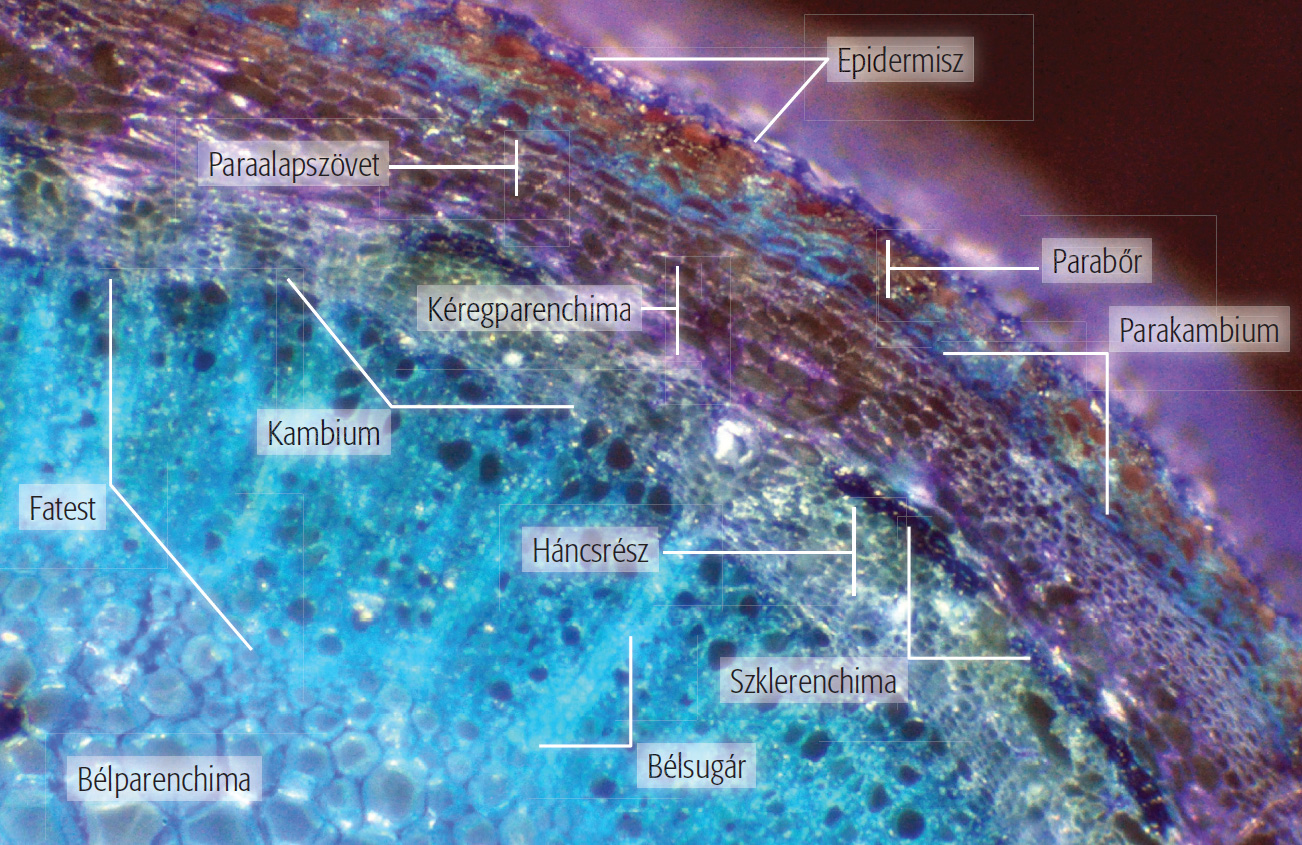
A fatörzs a fás szárú növények különleges szerve, amelynek felépítéséről és működéséről a törzskeresztmetszet bogárnézős vizsgálatával rántjuk le a leplet. A fatörzs metszetén jól elkülönül a külső réteget adó fakéreg és a belül elhelyezkedő fatest. Mint azt már korábban láttuk, a fakéreg külső részét parabőrrétegek, míg a belső részt a héjkéreg és az ezt létrehozó, legbelül elhelyezkedő háncstest adja. A fatörzs vékony hengerpalástszerű háncstestében szállítódnak a szerves anyagok, ezért ha akár csak 1 cm-es gyűrűben eltávolítjuk egy fa kérgét, az elkerülhetetlenül a növény pusztulását okozza. A háncstest alatt szintén hengerpalástszerűen helyezkedik el egy osztódószövetből álló vékony réteg (kambium), amely kifelé a háncstestet, míg befelé a fatestet fejleszti. A háncstestnek mindig csak az osztódószövet melletti vékony rétege vesz részt az anyagszállításban, a korábban képződött rétegek kifelé tolódnak és felszakadozva a fakéreg részévé válnak. Ezzel szemben a fatest évről évre képződő rétegei megmaradnak és a fatestet vastagítják. A fatestben szállítódik a hajtásba (leveles szár) a talajból felvett ásványi sók oldata. A fatestnek a háncstesttel ellentétben nemcsak az osztódószövet melletti részei, hanem a belsőbb rétegei is részt vesznek az anyagszállításban, de a fatörzs középső részét már elhalt fatest adja. A fatestben sugárirányú bélsugarak futnak, amelyek a szállítósejtek táplálásában és anyagforgalmában vesznek részt. Amikor a fák elérik a közel 20 éves kort, akkor a törzsük belsejében gesztesedési folyamat indul be, amelynek eredményeként a farész víztartalma jelentősen csökken és az elhalt sejtekben gyanta, alkaloidok, festék- és cserzőanyagok halmozódnak fel, amelyek ellenállóvá teszik a fa belsejét a gombákkal és más károsító hatásokkal szemben. Az így kialakuló geszt sötétebb, mint a kambium melletti még működőképes és nagyobb víztartalmú farész, a szijács. A nyár- és fűzfáknál nem képződik geszt, ezért ezek törzse sokkal gyakrabban odvasodik.
A fatestben a világosabb és sötétebb koncentrikus körök, az évgyűrűk kialakulása az évszakok váltakozására vezethető vissza. Tavasszal a rügyfakadást követően jelentősen megnő a növény vízigénye, ezért ilyenkor az osztódószövet henger tágüregű szállítósejteket képez, amelyek világosabb színű rétegét korai pásztának nevezzük. Nyár végén a virágzás és a termésérés után a fa vízigénye lecsökken, ekkor már szűküregű szállítósejtek keletkeznek, amelyek a sötétebb színű késői pásztát adják. Tehát egy év alatt egy világos és egy sötét színű gyűrű képződik a fatestben. Nedvesítsük be a fatörzs részletet és helyezzük bogárnéződbe! A nagyítás miatt jól megfigyelhetők a fatestben sugárirányban futó bélsugarak, amelyek a háncstestben is folytatódnak. Ezek világos foltjai között látható a sötét színű háncstest. A fakéreg külső részében jól láthatók a parabőrrétegek. A fatestben határozottan elkülönülnek a korai pászták világos és a késői pászták sötét gyűrűi.
A fa életkorát is megbecsülhetjük az évgyűrűk segítségével, de azt ne felejtsük el, hogy a fatörzsön felfelé haladva egyre kevesebb évgyűrűt találhatunk és a hajtástengely csúcsán elhelyezkedő ág csupán egyéves. Esetenként egy év alatt két évgyűrű is keletkezhet a fatörzsben. Ha például súlyos fagykár vagy hernyórágás pusztítja el a teljes lombkoronát, akkor az alvórügyekből új lombozat fejlődik, és ilyenkor két évgyűrű keletkezik egy évben. Az újabb évgyűrű kialakulását okozhatja a hosszúra nyúlt ősz során bekövetkező másodvirágzás is, ami újra tágüregű szállítósejtek termelődését és korai pászta megjelenését okozza.
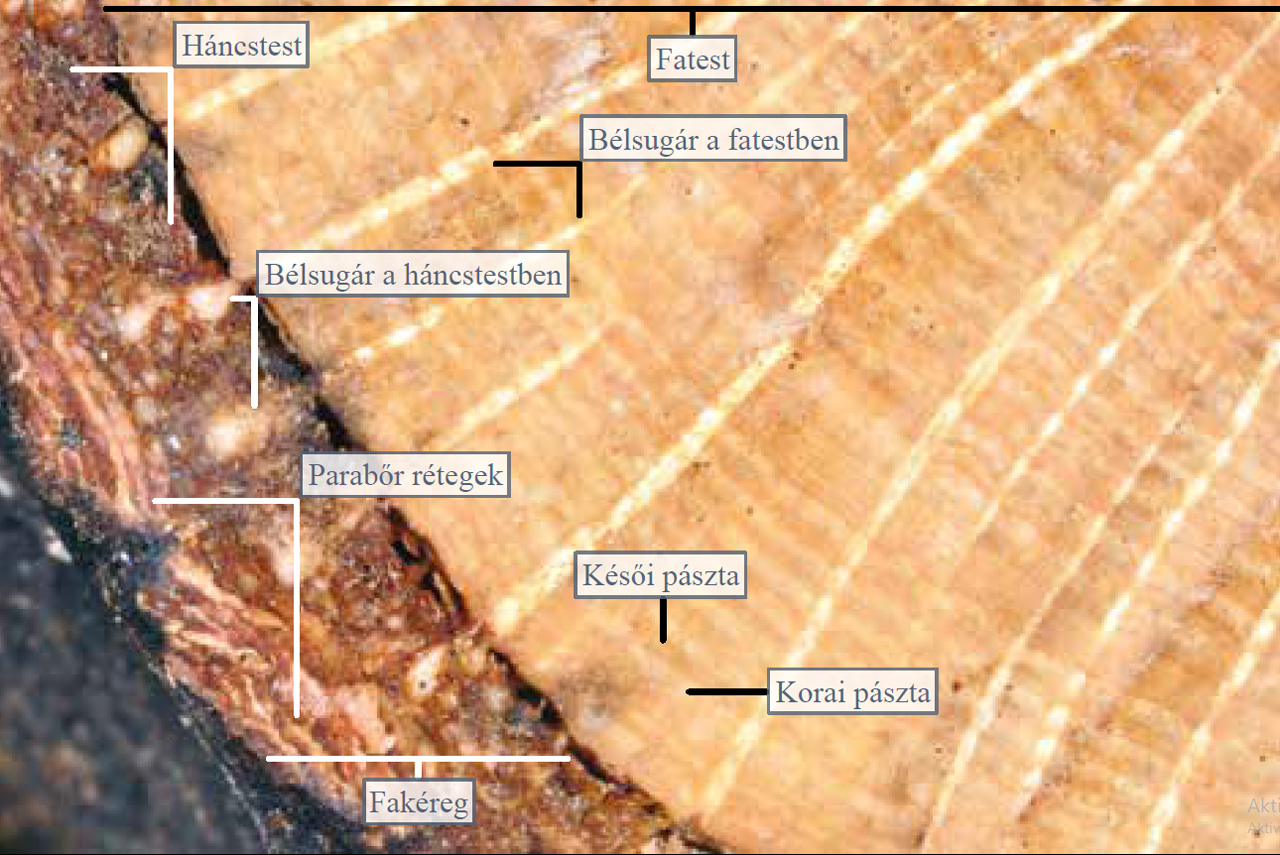
9.21. ábra. Fatörzsmetszet nagyított részlete
9.2.3.2.3. Az eperfa levélerezete
Az eperfa Közép-Ázsiából származó fa, amely egész Európában elterjedt. Régebben szinte minden parasztháznál megtalálható volt a Dunántúlon szederfának nevezett növény, de ma már kevésbé ültetik, mert gyümölcse, amely valójában áltermés, korán lehullik és nem is különösebben ízletes. Hazánkban két faja, a fehér és a fekete eperfa él. A fehér eperfa fiatal leveleivel régebben nagy mennyiségben gyűjtötték, mert ezzel etették a hernyóselyem miatt tartott selyemhernyókat. Vizsgáljuk meg az eperfa levelét bogárnézőben áteső fényű megvilágítás mellett! Az eperfa levelének ujjas levélerezete van, a levélbe belépő főér öt sugárirányú oldalérre oszlik. A levélerek többszörösen elágazódva és egymással összekapcsolódva teljesen behálózzák a levéllemezt. Erősebb nagyításnál megfigyelhetjük a levélerek egymásba csatlakozását és a legkisebb erekkel körülvett levélrészleteket, az érszigeteket. A levélerezet tanulmányozása során észrevehetjük, hogy a levélszél csipkéinek tövében, közvetlenül a levélfelszín alatt, több levélér is összeolvad. Párás, nedves időben, amikor a növények nem tudnak párologtatással vizet leadni, itt megy végbe a levél cseppkiválasztása. Ekkor a szállítónyalábokból víz választódik ki, amely lecsöpög a csipkés levélszélről. A cseppkiválasztásra azért van szüksége a növénynek, mert párologtatás hiányában csak ezúton tudja fenntartani a gyökéren keresztül felvett tápanyagok áramoltatását a levelek felé.

9.22. ábra. Az eperfa levele a bogárnézőben áteső fényű megvilágításnál
9.2.3.2.4. Pillangós virágú növény gyökérzete
A pillangós virágú növények a rétek, gyomtársulások gyakori növényei. A vörös- és fehérhere, a tarka koronafürt, a szennyes- és a kaszanyűg bükköny a leggyakoribb képviselőik. Ássunk ki egy növényt a talajból, és a gyökérzetét mossuk le folyó vízzel. Itassuk le a vizet a gyökérzetről, majd ennek egy részletét vizsgáljuk meg bogárnézőben! A pillangósvirágúaknak elágazó főgyökérzete van, a vastagabb főgyökérből többszörösen elágazódó és egyre vékonyabb oldalgyökerek erednek. A legvékonyabb gyökérágak csúcsi részéhez közel található a felszívási zóna, ahol a gyökérszőrök találhatók. A pillangós virágú növények jellegzetes gyökérmódosulatai a gyökérgümők (nem tévesztendők össze a gyökérgumókkal). Ezekben nitrogénkötő baktériumok élnek. A nitrogénkötő baktériumok képesek megkötni a levegő nitrogéntartalmát, amiből a gazdanövénynek is juttatnak. A baktériumok tevékenysége jó hatással van egyrészt a pillangós növény fejlődésére, másrészt a talaj nitrogéntartalmát is gyarapítja, amivel növényi tápanyagban gazdagabbá válik a talaj. Ezért is szokták a termőföldeken a „talajjavító” pillangósvirágúakat vetésforgóban más haszonnövényekkel felváltva termeszteni.
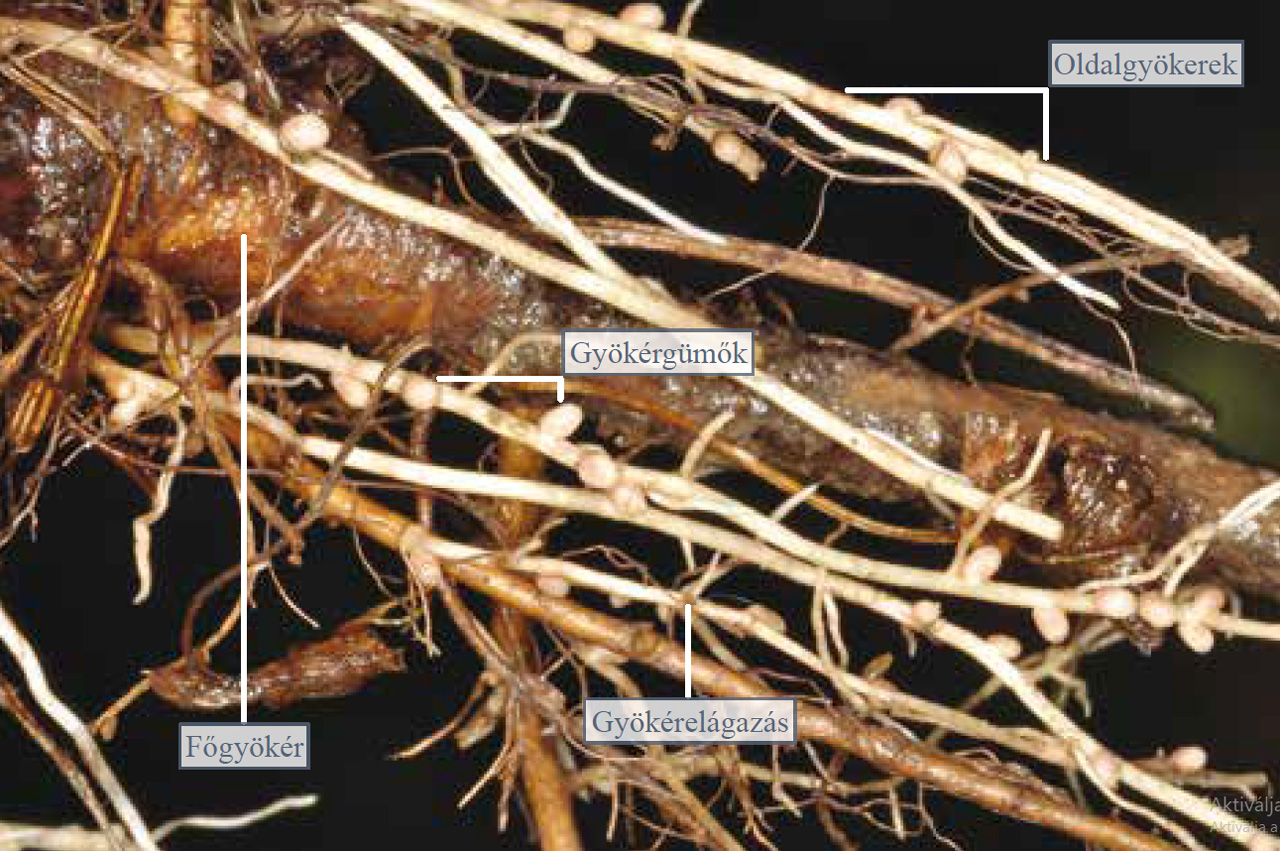
9.23. ábra. Erős nagyítású kép az oldalgyökereken sorakozó gyökérgümőkről
9.2.3.2.5. A vadrepce virága
A keresztes virágú növények közönséges tagjai a rétek és gyomtársulások növényzetének, ahol sárga és fehér szirmú képviselőik élnek. A vadrepce, a kányazsombor, az útszéli zsázsa, a homoki ternye és a hamuka a leggyakoribb fajaik.
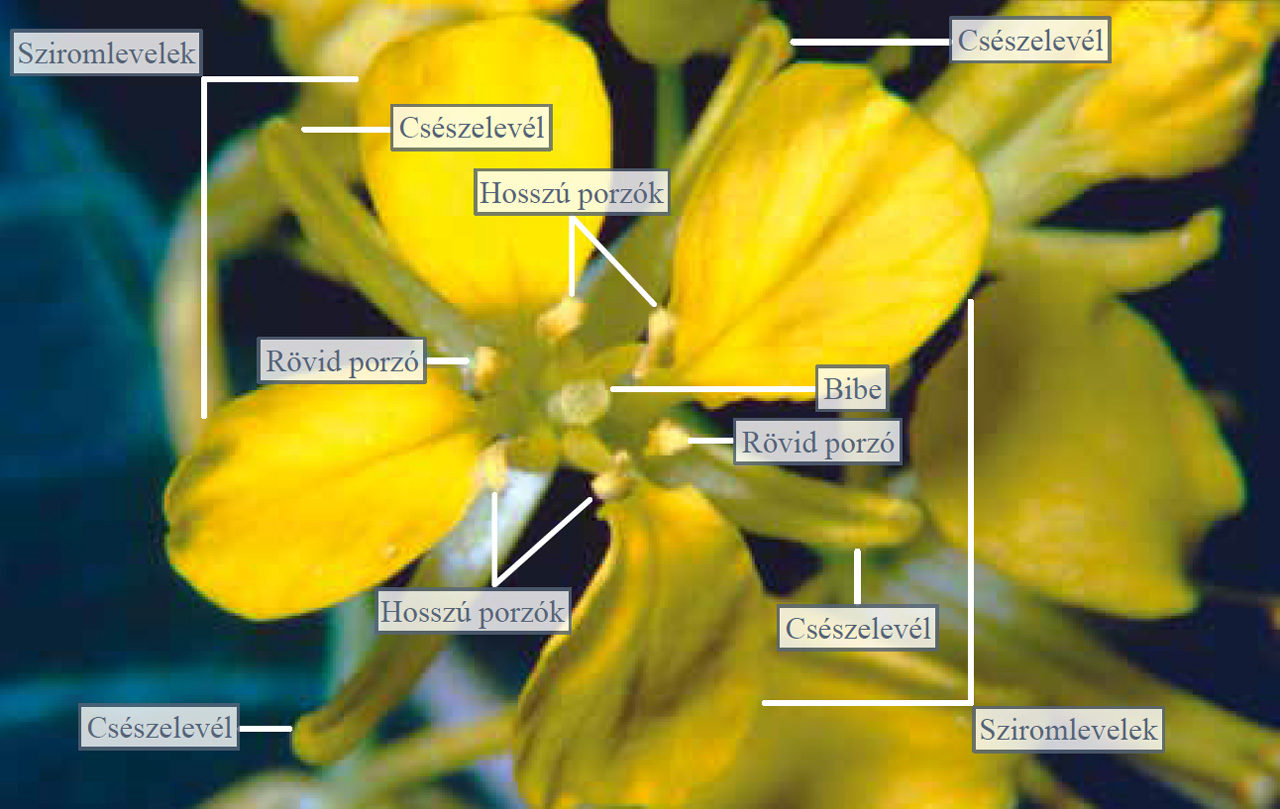
9.24. ábra. A vadrepce virága felülnézetben
Jellegzetes virágfelépítésüket a vadrepce segítségével ismerjük meg. Helyezzük a vadrepce virágát bogárnézőbe és vizsgáljuk meg a felépítését felülnézetből! A virág első ránézésre sugaras szimmetriájúnak tűnik, de a porzók elhelyezkedését megvizsgálva megállapíthatjuk, hogy kétoldali a szimmetriája. A virág legkülső körében 4 csészelevél áll keresztben, amelyekhez képest váltakozó helyzetűek a sziromlevelek, amelyek szintén keresztben állnak (innen ered a növénycsalád neve). A külső porzókörben csak két rövidebb porzó látható (emiatt kétoldali szimmetriájú a virág), míg a belső porzókör 4 hosszabb porzóból áll. Legbelül helyezkedik el a termő.
9.2.3.2.6. A tulipán virága
A tulipánnak a közhiedelemmel ellentétben se sziromlevele, se szirma nincs, mert takarótája egyforma lepellevelekből álló lepel. Ezért ha alulnézetből vizsgáljuk meg a virágot, akkor sem láthatunk rajta zöld színű csészeleveleket. Ellenben láthatunk három külső vagy alsó lepellevelet, amelyek között előtűnik a három belső vagy felső lepellevél. A virág egy rövid szártagú hajtás, ami azt jelenti, hogy levelei, a tulipán esetében a lepellevelek, a porzó és a termő nem egy pontból erednek, hanem az egészen rövid szárrész egymás fölött elhelyezkedő szárcsomóiból, amelyek nagyon közel esnek egymáshoz.

9.25. ábra. A tulipán ivarlevelei a háttérben a lepellevelekkel
A tulipán lepellevelei két körben helyezkednek el hármasával, amit úgy is mondhatunk, hogy a lepellevelek két egymás fölött elhelyezkedő szárcsomóból erednek. Ha felülről tekintünk a virágra, akkor azt látjuk, hogy a 6 lepellevél közül 3 egy külső, míg 3 egy belső kör mentén helyezkedik el. Beljebb haladva 6 porzó következik, amelyek a lepellevelekhez hasonlóan szintén két körben állnak hármasával. Legbelül a termő látható, amelynek háromágú bibéje egyértelműen jelzi, hogy a termő 3 termőlevélből nőtt össze. Az eddigiekből látható, hogy a tulipán virágfelépítésére, hasonlóan más egyszikű növényekhez, a hármas szám jellemző. A portokokból nagy mennyiségű pollen (virágpor) szabadul fel, amely a lepellevelek belső felszínén is látható. A virág beporzásakor a pollenszemek a bibe felületén kötődnek meg. A virágporszemek megtapadását a bibe ragacsos felszíne és az itt megfigyelhető bojtos felület segíti, amit a bibe bogárnézős vizsgálatával figyelhetünk meg.
9.2.3.2.7. A napraforgó fészekvirágzata
A napraforgó apró virágai nem egyesével állnak, hanem százával alkotnak egy fészekvirágzatot. Az ellaposodott és megvastagodott virágzat tengelyen kívülről befelé nyílnak a virágok. A napraforgó fészkes virágzatának peremén erednek a sárga nyelves virágok. Ezek hiányos virágok, nem tartalmaznak ivarleveleket.

9.26. ábra. Erős nagyítású kép a napraforgó virágairól
A feladatuk csupán annyi, hogy élénksárga pártájukkal a virágzathoz csalogassák a beporzásban részt vevő rovarokat. A nyelves virágoktól befelé helyezkednek el a csöves virágok. Erősebb nagyításnál jól felismerhető a csöves virágok pártacsöve és pártacimpái. Ezek veszik körül a virágból kiemelkedő sötét színű portokcsövet, amely a portokok összenövéséből alakult ki.
9.2.3.2.8. A paradicsom bogyótermése
Készítsünk vékony hosszanti metszetet a paradicsom bogyóterméséből és vizsgáljuk meg bogárnézővel áteső fényű megvilágítás mellett! A paradicsomot kívülről a hártyás bőrszövet borítja, amely alatt a húsos termésfal látható. Ennek különösen a külső része tartalmaz sok piros színanyagot (likopin).
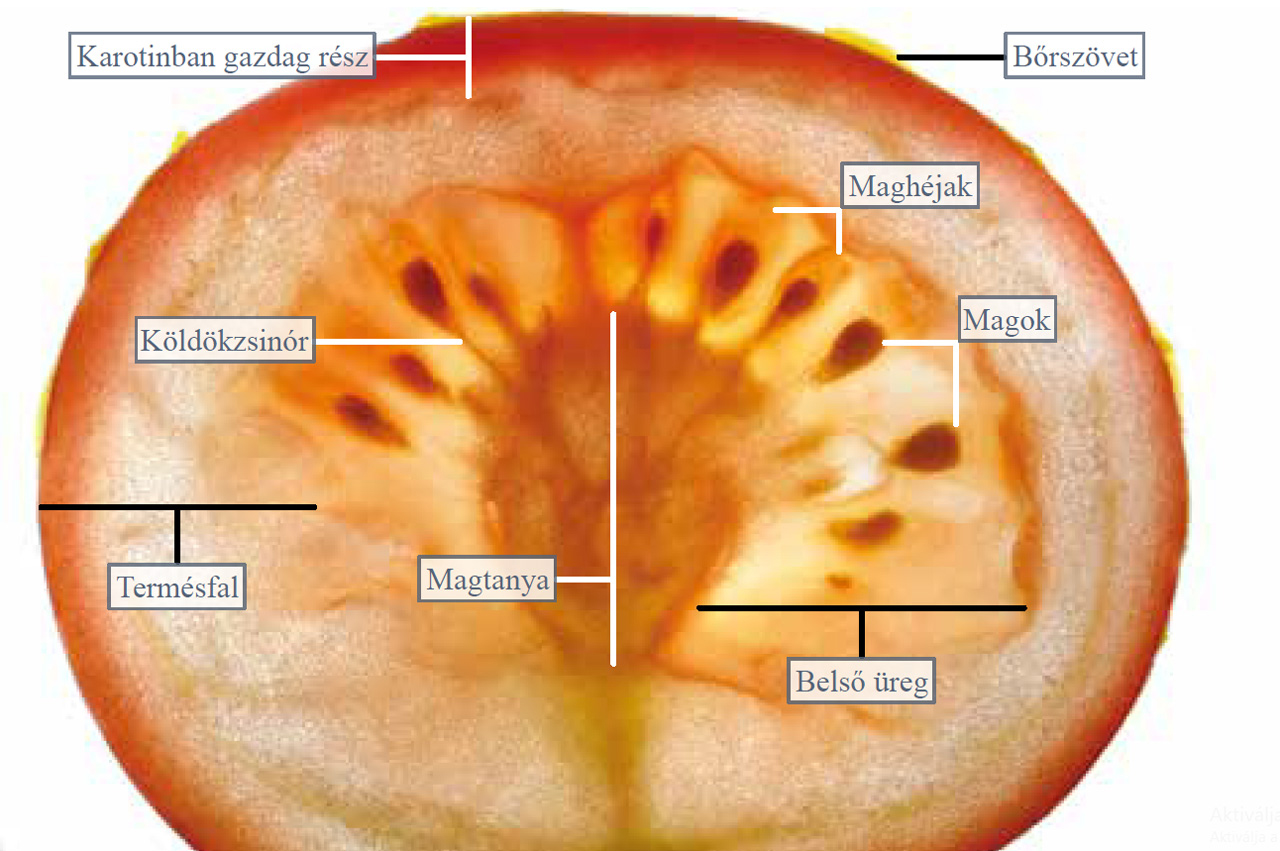
9.27. ábra. A paradicsom hosszanti metszete a bogárnézőben, áteső fényű megvilágítás mellett
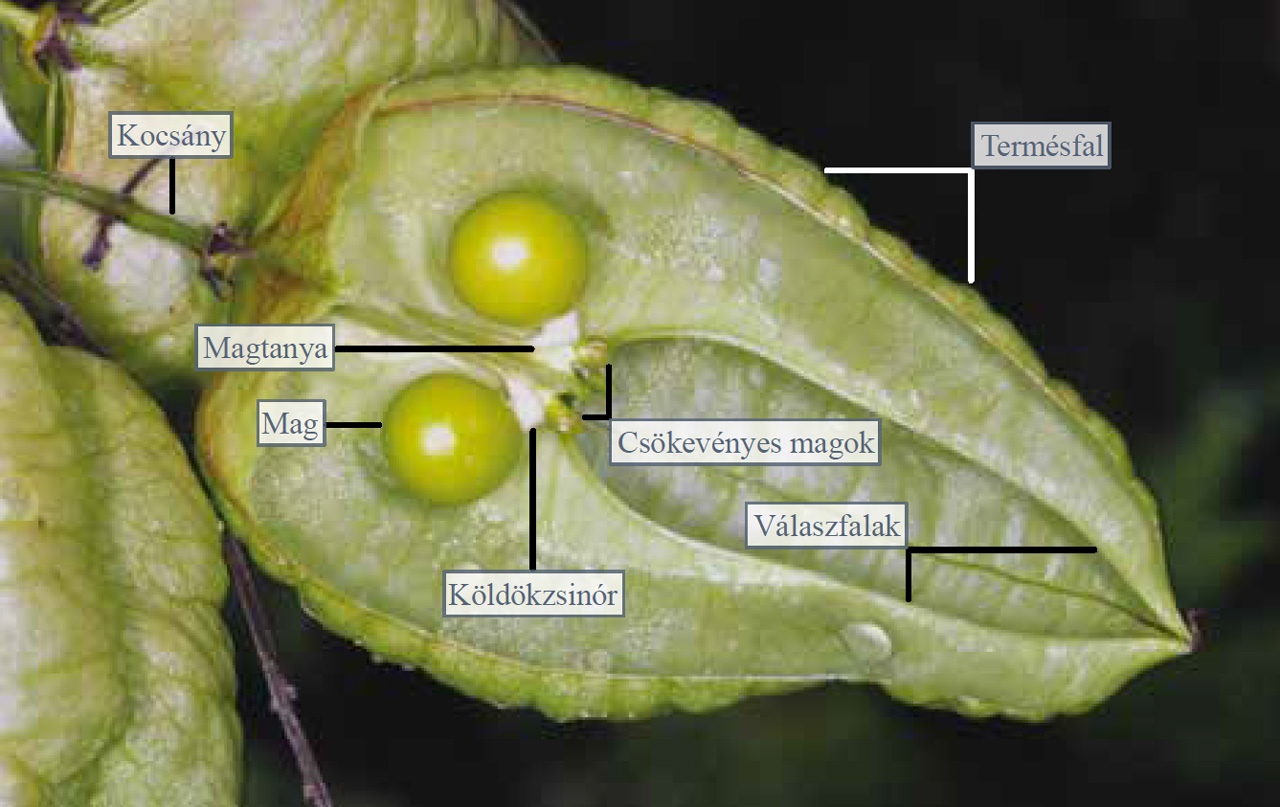
Középen látható a magtanya, amelyhez köldökzsinórral kapcsolódnak a magvak. A paradicsom magjainak elnyálkásodó maghéja adja a termésfal alatt elhelyezkedő magas víztartalmú kocsonyás réteget. Ez gyakran teljesen kitölti a termésfal belső felszíne és a magtanya közötti teret. Készítsünk horizontális metszetet is a paradicsomból, és ezt is vizsgáljuk meg bogárnézőben! A horizontális metszeten jól felismerhető, hogy a termésfal válaszfalai 3 rekeszre (a különböző fajtájú paradicsomoknál változhat a válaszfalak száma) tagolják a bogyótermés belső terét. A 3 termő rekeszbe benyúlnak a magtanya karéjai, amelyekhez köldökzsinórral kapcsolódnak az elnyálkásodott héjú magvak.
9.2.3.2.9. A csörgőfa toktermése
A parkokba, utak mellé ültetett fának 3–6 cm-es, háromélű termése van. Az éretlen toktermés színe zöld, amely nyár végére narancssárga, majd sötétbarna lesz. A hólyagra emlékeztető termések az őszi lombhullást követően, egész télen rajta maradnak a fán. A toktermés belsejében éretten 5–8 mm-es fekete magvak találhatók. Vizsgáljuk meg bogárnézőben! A termés hosszmetszetén megfigyelhetjük a központi részen elhelyezkedő magtanyához kapcsolódó magvakat és a válaszfalakat. A termés belső válaszfalak csak részben különítik el egymástól a tok rekeszeit.
9.28. ábra. A csörgőfa toktermésének hosszmetszete a bogárnézőben
9.2.3.2.10. Borsómagvak csíráztatása
A borsómagot kívülről maghéj borítja, a belsejében pedig az embrió található, amely a két sziklevélből és a közöttük rejtőző csírából áll. A csíra két fő része a rügyecske, amelyből a hajtás (leveles szár) és a gyököcske, amelyből a gyökér lesz. A két nagy sziklevélben tápanyagok vannak, amelyek a növekedő csírát táplálják. A sziklevelek között az aprócska csírát a száraz borsóban is felismerhetjük bogárnézővel. Érdemesebb azonban a már csírázásnak indult borsószemet felhasználni a csíra vizsgálatára, mert ezt könnyebben fel lehet nyitni, mint a csontszáraz magot, és a benne lévő csíra is már nagyobb méretű, ami segíti a megfigyelést. A csírázás első lépéseként a borsószemek vizet felvéve megduzzadnak, a maghéjuk megreped. Ezt követően a gyököcskéből fejlődő gyökér a köldök közelében kilép a magból.

9.29. ábra. Csírázó borsómagvak
A köldök egy forradás a maghéjon, amely köldökzsinór és a magkezdemény egykori kapcsolódási helyét jelzi. A gyökéren oldalgyökerek jelennek meg, amelyek rögzítik a növényt. Később a lomblevelek is erőteljes fejlődésnek indulnak. A borsó csírázása a babéhoz hasonló, azzal a különbséggel, hogy a sziklevelek nem emelkednek ki a lomblevelekkel együtt, hanem a talajban maradva táplálják a fejlődő növényt. A borsó fejlett csíranövényének gyökerén a gyökérszőröket, a hajtáson a levelek kezdeményeit figyelhetjük meg.
9.2.3.2.11. A kukorica csíráztatása
A kukoricaszem kialakításában a magkezdemény mellett a termésfal is részt vesz, ezért ez valójában nem mag, hanem szemtermés. A babbal és a borsóval ellentétben a kukoricaszem raktározott tápanyagai nem a sziklevélben, hanem a mag táplálószövetében vannak. A sziklevél egy pajzsszerű képződmény, amely a csírát választja el a kukorica sárga táplálószövetétől. Csírázáskor a felszakadó termésfal alól a gyökérhüvellyel borított gyökér bújik ki elsőként.

9.30. ábra. A kukoricaszem csírázásának kezdeti és későbbi szakasza
Később a csíra másik pólusán fejlődésnek induló rügyhüvellyel körülvett hajtás is kilép a szemtermésből. A kukoricánál a babbal és borsóval ellentétben a szikközépi szárból mellékgyökerek nőnek ki. A gyökerek felszívási zónáján jól felismerhetők a gyökérszőrök, a gyökércsúcson pedig a nyálkás gyökérsüveg látható, amely a gyökér talajban való előrehaladását segíti. A búzaszem csírázása a kukoricához hasonlóan történik. A fönti képen a fejlődő gyökér egyes zónái is jól felismerhetők.
9.2.3.2.12. Gerinctelen állatok vizsgálata

9.31. ábra. Füles planária

9.32. ábra. Rabló szitakötő lárvája
A háromnézetű bogárnéző különösen hasznos eszköze a terepi rovartani vizsgálatoknak, mert ilyenkor lehetőségünk van arra, hogy mindenféle veszély nélkül alaposan szemügyre vehessük az állatokat. Az eszköz átlátszó pohara vízálló, ezért alkalmas vízi gerinctelen állatok vizsgálatára is. A nagy népszerűségnek örvendő vízminősítési terepgyakorlatok többnyire ezeknek az élőlényeknek a felismerésén alapulnak, az állatok azonosítása során pedig olyan morfológiai bélyegeket kell felismernünk, amelyekhez elengedhetetlen valamilyen nagyítóeszköz használata.